- Movimiento que se realiza sobre una línea recta.
- Velocidad constante; implica magnitud y dirección constantes.
- La magnitud de la velocidad recibe el nombre de celeridad o rapidez.
- Aceleración nula.
La distancia recorrida se calcula multiplicando la magnitud de la velocidad por el tiempo transcurrido. Esta relación también es aplicable si la trayectoria no es rectilínea, con tal que la velocidad o módulo de la velocidad sea constante. Por lo tanto el movimiento puede considerarse en dos sentidos; una velocidad negativa representa un movimiento en dirección contraria al sentido que convencionalmente hayamos adoptado como positivo.
Sabemos que la velocidad 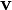 es constante; esto significa que no existe aceleración.
es constante; esto significa que no existe aceleración.
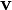 es constante; esto significa que no existe aceleración.
es constante; esto significa que no existe aceleración.
La posición  en cualquier instante
en cualquier instante 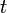 viene dada por
viene dada por
 en cualquier instante
en cualquier instante 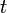 viene dada por
viene dada por .
.
Para una posición inicial 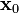 y un tiempo inicial
y un tiempo inicial 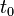 , ambos distintos de cero, la posición para cualquier tiempo está dada por
, ambos distintos de cero, la posición para cualquier tiempo está dada por
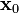 y un tiempo inicial
y un tiempo inicial 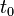 , ambos distintos de cero, la posición para cualquier tiempo está dada por
, ambos distintos de cero, la posición para cualquier tiempo está dada por
- En la siguiente imagen podemos observar un movimiento rectilíneo uniforme.

